抑郁症是一种常见的精神障碍,其特征是认知和行为症状的异质性。新兴的功能性连接组学研究范式为解析抑郁症中脑网络的组织和功能的变异提供了量化的理论框架和分析工具。本文中,我们首先讨论了与抑郁症相关的功能性连接组的最新进展。然后,我们讨论了抑郁症中特定治疗的大脑网络结果,并提出了一个假设模型,突出了每种治疗在调节特定大脑网络连通性和抑郁症症状方面的优势和独特性。最后,我们期待在临床实践中结合多种治疗类型的未来前景,使用多站点数据集和多模式神经影像学方法,以及确定生物性抑郁症亚型的前景。本文发表在Trends in Cognitive Sciences杂志。
关键词:抑郁症,抗抑郁治疗,静息状态网络,功能性磁共振成像,连接组,特定疗法的网络连通性
亮点:
抑郁症患者通常表现出认知和行为缺陷,其特征是异质性症状,其神经生物学机制仍然未知。
抑郁症有不同的治疗类型。然而,反应和缓解率仍然较低,治疗效果的神经生物学基础不清楚。
功能性连接组学为将抑郁症描述为脑网络疾病并指导治疗决策提供了有用的工具。
最近的工作表明,多维度的抑郁症症状与不同脑网络的功能连接和网络组织的异常有关。每种治疗类型倾向于通过调节特定的网络来改善特定的症状,这暗示了需要联合治疗。
确定由网络指导的,针对症状的个性化治疗目标是解决抑郁症和治疗反应中的异质性的关键。
我们提出了一个假设模型,提供了一个理论框架,用于假设测试,将功能连接组的变化与主要抑郁症的特定症状和疗法相关联。
抑郁症和疗法:大脑网络视角
抑郁症是一种常见且令人残疾的精神疾病,其特征是持续的抑郁情绪以及其他各种异质性症状,如失去快乐或兴趣,感到内疚和无价值,食欲和体重的变化,疲倦和缺乏精力,睡眠障碍,以及认知功能(如注意力和记忆)的损害[1]。此外,抑郁症是持久性幸福感和生活质量损害的主要原因,与显著的病率和死亡率相关[2]。
在临床实践中,有各种治疗方法可用,如药物治疗[3],心理治疗[4],神经调制[5]和睡眠剥夺(SD)[6]。通常,抑郁症患者使用各种抗抑郁药物或不同类型的心理治疗(如最常用的认知行为疗法(CBT))进行药物治疗。然而,大约30%的抑郁症患者对药物治疗或心理治疗没有反应[7]。为了提高治疗反应(参见术语表)和临床缓解率,当药物治疗或心理治疗的全部过程完成而没有足够的改善时,对于治疗抗性抑郁症(TRD)[8]的患者,人们使用了替代治疗选项。具体来说,神经调制方法,如经颅磁刺激(TMS)[9],电休克治疗(ECT)[10]和深脑刺激(DBS)[11,12],已被用来通过调节大脑中的神经活动来改善抑郁症症状。
关键的是,当治疗与影像学结合时,可以帮助揭示症状改善的因果回路机制[13]。诸如氯胺酮和睡眠剥夺等引发快速抗抑郁效应的方法尤其引人注目,因为它们为研究大脑快速变化如何能引发抑郁症的快速缓解提供了可实验的机会[6,14]。然而,由于响应/缓解率低和复发率高[3,4,6,9,11,15],这些干预措施还不是最佳的,迫切需要确定抑郁症的神经生物学机制和有效疗法,因为这对于开发新的干预措施和确定新的个性化治疗目标具有希望。
理解人脑的功能连接和拓扑组织,通常被称为功能连接组,对于理解正常的大脑功能[16]和脑疾病的神经生物学机制[17., 18., 19., 20.]至关重要。特别是,抑郁症越来越被认为是一种脑网络疾病[21., 22., 23., 24.]。因此,越来越多地将抗抑郁治疗概念化为通过调节多个大脑子网络的功能连接性来改善抑郁症症状的网络疗法(参见评论[13,25., 26., 27.])
在本文中,我们首先简要描述了人类功能性大脑网络的关键概念和组织结构。在接下来的两个部分,我们回顾了未经治疗的抑郁症患者的功能性大脑网络异常和相关抑郁症状的现有经验数据。然后,我们讨论了抑郁症中特定于治疗的功能网络变化。特别是,我们强调了每种治疗在调节特定网络连接性和抑郁症的维度症状方面的优势和独特性。接下来,我们提出了一个假设性的三维网络模型,为理解大脑网络连接性变化、特定抑郁症状和抑郁症中不同治疗效果之间的关系提供了概念框架。最后,我们概述了在临床实践中结合使用多种治疗类型、多站点数据集和多模式神经影像学方法,以及识别生物学抑郁症亚型以解决疾病异质性和开发新的症状特异性和连接组指导的治疗目标的前景。有关我们如何识别相关研究的信息,请参见在线补充信息。
人类大脑是一个复杂的网络(即连接组),由子网络和枢纽(高度连接的大脑区域)组成[16,18,28]。在本篇回顾中,我们关注使用功能磁共振成像(fMRI)数据确定的功能性大脑网络研究。静息态fMRI(rs-fMRI)研究已经发现了多个子网络,也被称为静息态网络(RSNs;Box 1和图1),包括默认模式网络(DMN)、额顶网络(FPN)、突显网络[SAN,也被称为扣带-眶侧网络(CON)[29]或腹侧注意力网络(VAN)] [30]、边缘网络(LIM)、背侧注意力网络(DAN)、体感运动网络(SMN)和视觉网络(VIS)。这些RSNs每个都在特定的认知和/或行为领域中起着重要作用[31],他们的架构对于维持大脑功能至关重要。重要的是,这些RSNs由枢纽连接,如DMN中的楔前叶、角回和内侧前额叶皮层(vmPFC)[32]以及FPN中的后部中央前回(MFG)[33]。这些枢纽促进了从多个RSNs的有效通信和信息整合[34]。从静息态或任务相关的fMRI数据中估算的功能网络连接性表现出比解剖和扩散MRI(dMRI)测量更好的行为预测性能,无论是回归模型还是行为测量[35]。这突显了在抑郁症背景下研究功能网络异常的重要性。
Box 1 静息态网络(RSNs)
默认模式网络(DMN)包括内侧前额叶皮层(mPFC)、后扣带皮层(PCC)、楔前叶、内侧顶叶(IPL)和中颞叶[36]。这个任务负性网络在自我参照过程中起着重要作用,如评估内部和外部线索的显著性,记忆过去,规划未来。
额顶网络(FPN)[29],也被称为执行控制网络[191],包括背侧前额叶皮层(dlPFC)、眶额皮层(OFC)、中央前回(MFG)、上额回(SFG)、前扣带皮层(ACC)和其他在目标导向任务中活跃的大脑区域[31]。这个任务正性网络与执行控制、认知重新评估和自上而下的注意力和情绪处理调节有关。有人建议FPN可能包含两个独立的子网络:一个连接到DMN并参与内省过程的调节;另一个连接到DAN并参与视空间知觉注意的调节[192]。
fMRI研究识别出的边缘网络(LIM)与大脑半球与脑干之间解剖学界限定义的边缘系统在解剖学上存在重叠。具体来说,像杏仁核、海马、纹状体、丘脑和岛叶这样的皮质下区域是LIM的核心组成部分,并参与记忆、奖赏以及情绪和行为过程[193]。
由前扣带皮层(dACC)、前岛叶(AI)和纹状体组成的突显网络(SAN)参与检测和引导注意力向突显刺激,以及在内部和外部思考之间切换[20,37]。与以逐试验为基础启动和调整控制的FPN相反,SAN在任务中提供稳定的目标导向控制[194]。SAN也被称为扣带楔前网络(CON)[29]或腹侧注意网络(VAN)[30]。最近的一项综述研究[195]推荐使用通用分类法命名RSNs,其中SAN、CON和VAN被命名为"中扣带-岛叶网络"。
有两个感觉定向注意系统,VAN(或SAN)和背侧注意网络(DAN)[196]。VAN参与将注意力引向突然出现的刺激,而不是将注意力引向当前任务的焦点刺激。DAN 包括后顶内沟、额眼区、中颞区、腹侧前运动皮层、中央前回和中央后回。DAN主要参与目标导向和主动定向视空间注意力[30]。
fMRI和多模式MRI研究一致地识别出了一些感觉网络[197,198],如运动感觉网络(SMN)、听觉网络(AUD)和视觉网络(VIS)。SMN主要包括感觉(例如,中央后回)和运动(例如,中央前回)区域,并扩展到辅助运动区。这个网络在执行对身体对侧运动中起主要作用。AUD是处理听觉信息的颞叶的一部分。位于枕叶的VIS包括处理视觉信息的视觉皮层区域。

图1. 与认知相关的静息态网络(RSNs)
每个RSN被认为在特定的认知和/或行为领域中发挥重要作用:DMN,自我参照过程;LIM,记忆、奖励、情绪和行为过程;FPN,执行控制、情绪和注意力调节;SAN,警觉性、目标导向控制和情绪信息处理;DAN,目标导向的视空间注意力过程;SMN,运动和感觉运动过程;VIS,视觉过程(详见正文中的Box 1)。
颜色编码的节点表示由Yeo parcellation[208]定义的七个RSN。RSN的大脑映射由BrainNet Viewer绘制。
缩写:DAN,背侧注意力网络;DMN,默认模式网络;FPN,额顶网络;LIM,边缘系统网络;RSNs,静息态网络;SAN,突显网络;SMN,运动感觉网络;VIS,视觉网络。
在未经治疗的抑郁症患者中观察到的人类功能性大脑网络异常
许多基于功能磁共振成像(fMRI)的研究在单极或双极抑郁症患者与健康对照组相比,报告了包括默认模式网络(DMN)、额顶网络(FPN)、突显网络(SAN)和边缘系统网络(LIM)在内的多个静息态网络(RSN)的功能网络连接性存在异常。这些RSN涉及各种认知功能(见图1),例如自我参照思考(例如,DMN)[36],执行控制(例如,FPN)[20],检测和整合情感显著的内部和外部刺激(例如,SAN)[37],以及情绪和记忆处理(例如,LIM)[38,39]。具体来说,抑郁症患者在FPN [40,41]和SAN [42,43]中表现出低连通性(功能连接性降低)。然而,有些研究报告了在抑郁症患者相比对照组,FPN [44]和SAN [40]中的超连通性(功能连接性增加)。抑郁症患者也表现出DMN [40,45., 46., 47.]和LIM [48]的超连通性。然而,有些研究报告了DMN的低连通性[49]或混合结果[44,50]。一些研究还观察到在抑郁症中,视觉网络(VIS)[40]的超连通性以及背侧注意网络(DAN)[40,42],SAN [40]和运动感觉网络(SMN)[42]的低连通性,尽管这些发现报告的频率比DMN,FPN,SAN和LIM少。
不一致的结果往往归因于样本的遗传、环境和临床异质性,以及分析方法的可变性。使用多中心数据[51., 52., 53.]可以提高统计功效,产生一致且可推广的结果。在我们能够确定统一的分析框架之前,可靠的研究结果可能需要使用不同的方法进行验证(例如,脑图谱[51,54]、连接性[51,55]和网络[56]度量、预处理方法[57]等)。
关于网络间连接性,抑郁症患者在LIM和其他一些RSN之间表现出低连通性,例如FPN [58,59]、DMN [41,60]和SAN [61]之间的低连通性,DMN和FPN之间的低连通性[58],以及FPN和SAN之间的低连通性[43,44]。少数研究还报告了DMN和FPN之间的高连通性[40., 41., 42.],DMN和SAN之间的高连通性[40]或低连通性[42],以及FPN和DAN之间的高连通性[40]或低连通性[41,42]。
最近使用图论工具进行的连接组学研究还揭示了抑郁症中大脑网络的拓扑结构紊乱[23],包括全局完整性的紊乱(通过聚类系数[62]、最短路径长度[62., 63., 64.]和全局效率[63,64]量化)、模块化结构[65]和区域节点连接性的紊乱(通过节点度[64]、介数中心性[63,64,66]和局部效率[63,64]表征)。
总体而言,抑郁症与主要在DMN、FPN、SAN和LIM中的静息态网络(RSN)的拓扑结构和功能连接性的改变相关。
未经治疗的抑郁症中特定症状的功能性大脑网络异常
抑郁症患者通常具有如前所述的异质性症状。由于特定的抑郁症状在潜在的神经生物学上可能存在差异,症状特定的连接组学研究是鉴定生物标志物的有希望的工具[67]。近期的研究报道了一组抑郁症中特定症状的功能性网络异常[68]。具体而言,DMN内的超连通性[50,69., 70., 71., 72.]或低连通性[73]与反刍行为的增加相关。DMN内的超连通性也与悲观情绪的增加相关[74]。一些研究发现,情绪抑郁和焦虑程度较高的患者在SAN内(例如,腹侧纹状体(VS)-尾状核/扣带区)之间和FPN(例如,背外侧前额叶皮质(dlPFC))与SAN(例如,前岛皮质(AI))之间显示低连通性[75]。具有更严重情感迟钝的抑郁症患者显示了SAN内的超连通性(例如,VS-尾状核/扣带区)[75],DMN(例如,腹内侧前额叶皮质(vmPFC)-背内侧前额皮质(dmPFC))[77],VIS[77]以及DMN(例如,vmPFC)和右侧FPN(例如,右侧dlPFC)之间的超连通性,以及FPN(例如,MFG和背侧前扣带(dACC))和SAN(例如,纹状体)之间的低连通性[78,79],DMN(例如,vmPFC)和LIM(例如,腹侧中脑区/纹状体)之间的低连通性,以及DMN(例如,vmPFC)和左侧FPN(例如,左侧dlPFC)之间的低连通性[80]。此外,一些研究发现,体征症状严重程度较高的患者SAN内的神经活动较低(例如,背侧中岛皮层失活)[81],FPN(例如,眶前额叶皮质(OFC))和SAN(例如,前岛皮质(AI))之间的低连通性[82]。此外,抑郁症患者的更高神经质与SAN、FPN和SMN之间的网络内连通性增强,以及SAN-FPN、SAN-SMN和DMN-LIM之间的网络间连通性增强相关[83]。自杀倾向与FPN(例如,MFG/额叶上回(SFG))和SAN(例如,VS/腹侧纹状体)之间的网络连通性增强相关[75]。FPN中的灵活性低可能与焦虑综合征有关,而DMN中的低弹性可能提示着滞后效应[84]。此外,网络连通性的异常也与抑郁症的严重程度[64,75]、病程持续时间[42,63]、发作次数和持续时间[43,52]以及创伤性童年经历[40,85]相关。
综合而言,不同的抑郁症状与不同的RSN连接有关,例如DMN连接与反刍行为有关,FPN参与连接与抑郁情绪有关,SAN和FPN参与连接与焦虑有关,SAN、DMN、VIS和FPN参与连接与情感迟钝有关。
抑郁症中特定症状的功能性大脑网络变化
如前所述,抑郁症与多个与不同抑郁症状相关的大脑网络的功能连通性障碍相关。尽管这些发现的治疗意义尚不清楚,但可能的一个解释是抗抑郁干预通过有选择地调节病理连通性模式来改善抑郁症状。最近的神经影像研究为这种解释提供了重要的支持(见表1中列出的关键研究;完整列表请参见在线附加信息中的表S1)。在接下来的几节中,我们首先讨论治疗引起的连通性变化,然后探讨抑郁症的有针对性干预措施。
治疗引起的连接变化
抗抑郁药物
表1. 治疗引起的网络连通性变化
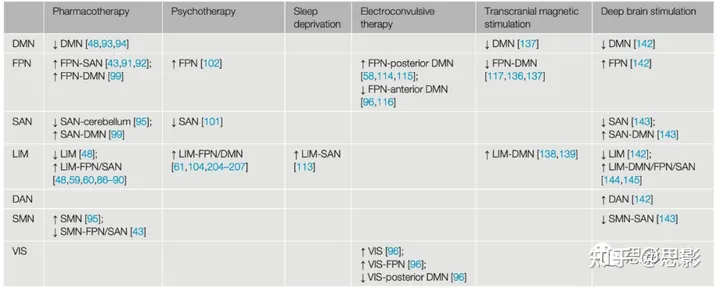
抗抑郁药物(例如选择性5-羟色胺再摄取抑制剂(SSRI)、5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRI)和氯胺酮;见附录2)通过调节FPN、DMN、SAN和LIM网络内部和之间的功能连通性(表1)改善抑郁患者的表现。许多功能磁共振成像(fMRI)研究,无论是在主动任务还是静息状态下,一致表明抗抑郁药物可以通过减少自我参照思维来帮助恢复情绪调节并促进积极心态。需要注意的是,药物诱导的LIM(如杏仁核、海马、内侧丘脑和伏隔核)连接性的减少[48]和FPN/SAN与LIM之间连接性的增加(如PFC/ACC与杏仁核、海马、内侧丘脑和苍白球纹状体之间的连接)[48,59,60,86., 87., 88., 89., 90.]可能反映了抗抑郁药物在抑制底层情绪过度唤醒和规范抑郁患者大脑皮质对潜在情绪过程的异常顶层控制方面的作用。请注意,具体的连通性变化可能因个体差异和治疗方法的不同而有所变化。
BOX 2 药物治疗
药物治疗主要涉及几种典型和非典型抗抑郁药物。典型抗抑郁药物通常包括选择性5-羟色胺再摄取抑制剂(SSRI,例如舍曲林、氟西汀、帕罗西汀、西酞普兰和艾司西酞普兰)、5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRI,例如文拉法辛、度洛西汀、阿戈美拉汀和米氮平)、三环类抗抑郁药、去甲肾上腺素和特异性5-羟色胺抗抑郁药以及5-羟色胺受体拮抗剂和再摄取抑制剂。非典型抗抑郁药物包括氯胺酮、安非他酮、阿米苏普利德等。典型抗抑郁药物如SSRI和SNRI通常被用作抑郁症的一线药物[199]。SSRI通过抑制释放它们的神经细胞中5-羟色胺的再摄取来发挥作用,从而增加大脑中5-羟色胺的活性。类似地,SNRI通过阻断5-羟色胺和去甲肾上腺素的再摄取来增加活性神经递质的水平。通常需要至少2-3周的时间才能缓解症状,3-6个月才能实现临床缓解。在接受SSRI/SNRI治疗的抑郁症患者中,约有40-60%的人对单疗程治疗有反应,缓解率通常在30-49%之间[3]。
有趣的是,克他命(ketamine)这种离子型谷氨酸能N-甲基-d-天冬氨酸(NMDA)受体拮抗剂,在单次亚麻醉剂量下产生了迅速的抗抑郁效果,持续时间长达7天,响应率为52.6%,缓解率为30%[14]。尽管许多抗抑郁药物作用于单胺神经递质(如5-羟色胺、去甲肾上腺素或多巴胺),克他命通过触发大脑最重要的神经递质谷氨酸的产生来发挥作用。谷氨酸受体分布于整个大脑和脊髓的神经元和胶质细胞中。
未来的研究对于探索不同抗抑郁药物在调节脑网络变化方面是否具有共同的或特定的机制具有极大的兴趣。例如,正如前文所讨论的,不同的抗抑郁药物通过增加或减少大脑中特定神经递质的水平来调节神经传递。值得注意的是,最近的研究[200]表明,多种神经递质系统的受体密度分布与连接组的结构和功能组织以及多种精神障碍的易感性相关,包括重度抑郁症。因此,未来的研究可以探索功能网络连接模式与不同抗抑郁药物作用靶向的特定神经递质受体密度之间的空间关系。
多个事件相关和静息态功能磁共振成像(rs-fMRI)研究还报告了抗抑郁药物引起的前额纹状体奖赏回路的功能连接增加【例如,ventrolateral prefrontal cortex (vlPFC)/ACC与尾状核/壳核之间的连接】[43,91,92]。这些发现表明,FPN与SAN之间的连接增强,导致奖赏加工的恢复,是抗抑郁药物治疗中临床改善的重要因素。抗抑郁药物还被发现调节了抑郁症中增强的DMN连接,这可以解释为恢复了适当调节自我参照活动的能力【48,93,94】。抗抑郁药物的效应还与其他RSN(如DAN、SMN、VIS和小脑-SAN)的功能连接变化【43,95., 96., 97.]或基线功能连接组特征(如连接组梯度、连接组指纹、功能连接强度)【53,83,98】相关。例如,最近的一个连接组研究【99】发现,在使用蘑菇毒素治疗后的第一天,DMN连接减少,DMN与FPN之间的连接和DMN与SAN之间的连接增加。
心理疗法
作为最常用的心理疗法,认知行为疗法(CBT)可以通过调节与情绪注意控制相关的脑网络(例如VAN/SAN)和认知控制相关的脑网络(例如FPN)来改善特定症状【100】。一项纵向的静息态功能磁共振成像(rs-fMRI)研究【101】报告了在重性抑郁障碍(MDD)和创伤后应激障碍(PTSD)患者接受12周CBT后,SAN中出现了症状特异性的连接改变。具体而言,该研究发现,在接受12周CBT治疗后,MDD和PTSD患者的抑郁症状改善与SAN内部和网络间连接减少相关,而焦虑唤醒症状没有这种关联。一项基于任务的CBT-fMRI研究【102】证实了症状特异性跨诊断脑-症状关联的发现。情绪冲突任务引起的FPN区域(例如dlPFC)异常的脑活动与MDD和PTSD患者在接受CBT后的抑郁症状改善相关。这些发现支持使用国立精神卫生研究所研究领域标准(RDoC;[103])基于行为维度和神经生物学测量来分类精神障碍的做法。
SD(睡眠剥夺)
SD【105】是一种有效且快速的抗抑郁治疗方法,通过单个晚上的完全或部分SD,可以使40-60%的抑郁症患者立即缓解抑郁症状(Box 3)。尽管SD的症状改善通常是短暂的(恢复性睡眠后,抑郁症状会复发),但它在临床设置中并不常用【106】。一些针对健康个体的研究显示,SD对脑网络连接的改变【105,107,108】和神经认知缺陷(例如,一次完全SD导致的情景记忆缺陷)具有影响【107】。然而,在抑郁症的SD神经影像学研究仍然较少,目前还不清楚SD如何通过调节脑网络连接来改善抑郁症状。
Box 3 心理疗法和睡眠剥夺(SD)
推荐多种类型的心理疗法作为抑郁症的一线治疗方法,包括认知行为疗法(CBT)、人际心理疗法(IPT)和问题解决疗法(PST)【4】。作为最常用的心理疗法之一,CBT侧重于识别导致持续抑郁情绪的认知失真,并利用情绪调节技巧改变不合理的思维方式。IPT是一种结构化和简短的干预措施,解决了维持抑郁症的社交问题。PST则教授问题解决技巧,旨在增强个体对环境的掌控能力,减少逆境体验。作为二线治疗方法,行为激活疗法专门针对维持抑郁症的问题行为,通过促进有益活动和抑制回避行为来改善抑郁症状(尤其是丧失兴趣的症状)。心理疗法通常需要每周45到90分钟的治疗课程,持续10到20周。总体而言,这些心理疗法的应答率在37%至46%之间,缓解率在26%至34%之间【4】。
SD已被证实是一种快速有效的抑郁症治疗方法(在失眠一晚后立即产生反应),总体应答率为45%至50%【6】。SD尚未广泛应用于临床实践,部分原因是它对抑郁症状的影响是暂时的(例如,当个体恢复睡眠后,情绪的临床改善效果就会减退)【106】。然而,临床改善的迅速开始和结束是一个优势,因为它使得可以采用ABA研究设计来探究其作用机制,从而更确切地确定因果关系。
背侧纽带(dorsal nexus,DN)是由Sheline等人【109】首次发现的,位于双侧背侧前额叶皮质的一个区域,与DMN、FPN和情感网络(如LIM)之间的连接增强,在抑郁症中有所涉及,并在抑郁风险较高的青少年【110】以及氯胺酮的作用机制【111】中发挥作用。一项针对健康参与者的部分SD(睡眠剥夺)的rs-fMRI研究【112】发现DN与dlPFC区域之间的功能连接增强,而后扣带后回皮层(PCC)与ACC之间的功能连接减弱。这表明从情感到认知网络对DMN的贡献的转变对于那些有过度ACC活动和/或受损dlPFC功能的抑郁症患者可能是有益的。这些发现暗示DN-dlPFC连接的改变可能是解释SD对快速抗抑郁治疗反应的潜在解释。
一项最新的研究使用完全睡眠剥夺(TSD)作为研究工具,并采用静息态功能磁共振成像(rs-fMRI)来研究背侧纽带(DN)和杏仁体相关连接性以及情绪变化之间的关系,研究对象包括接受了一晚完全睡眠剥夺疗法的抑郁症患者和健康人群[113]。研究发现,在健康人群中,完全睡眠剥夺疗法增强了杏仁体-腹侧前扣带皮质(ACC)和DN(背侧纽带)-背侧前额叶前皮质(dlPFC)的连接性。在情绪有所改善的抑郁症患者中,完全睡眠剥夺疗法后,杏仁体-ACC的连接性显著增加,而在情绪未改善的抑郁症患者中则没有这种现象。更重要的是,增强的杏仁体-ACC连接性与抑郁症患者的完全睡眠剥夺疗法抗抑郁效果以及健康人群的情绪改善相关联。这些发现支持了杏仁体-ACC回路在抑郁和健康人群的情绪调节中的关键作用,并表明快速抗抑郁治疗可能会针对增强杏仁体-ACC的连接性。
电休克疗法(ECT)
电休克疗法通过调节前额顶网络(FPN)与默认模式网络(DMN)不同组分之间的功能连接可能缓解抑郁症状。多项研究表明,在接受电休克疗法后,FPN与后部DMN之间的功能连接增加,可能成为从抑郁发作中康复的潜在生物标志。其中,两项静息态功能磁共振成像(rs-fMRI)研究【58,114】发现,在重性抑郁障碍(MDD)患者中,与对照组相比,电休克疗法引起了FPN(如前额侧前额叶皮层、前外侧前额叶皮层、前扣带回)与后部DMN(如后扣带皮层)之间的功能连接增加,并且这种增加与抑郁症状的改善相关【114】。另外一项针对难治性抑郁症的晚期患者的rs-fMRI研究显示,在接受电休克疗法后,后部DMN与FPN(如左侧前额侧前额叶皮层)之间的功能连接恢复正常,而且ECT反应者中的功能连接增加更为显著,非反应者中则较少【115】。
另外,还有证据表明,在抑郁症患者中,电休克疗法降低了FPN(如左侧前额侧前额叶皮层)与前部DMN(如背前额皮层和前扣带皮层)之间的功能连接。这些发现来自事件相关fMRI研究和静息态fMRI研究,伴随着功能连接的减弱,抑郁症状也显著减轻。这些研究结果表明,FPN与DMN不同子网络之间的功能连接变化可能对电休克疗法的治疗效果具有不同的贡献。
靶向干预
经颅磁刺激(TMS)
经颅磁刺激(TMS)是一种非侵入性神经调控技术,利用磁场来调节特定脑区的神经活动(见图示4)。然而,重复经颅磁刺激(rTMS)可以有效缓解许多(但并非所有,约30-40%)抑郁症患者的症状,可能是由于个体症状和脑网络组织的多样性。例如,有多个研究证据【117,118,119】表明,最有效的TMS靶点位于左侧背外侧前额叶皮层(dlPFC),该区域与亚属前扣带皮层(sgACC)呈现强烈的反相关关系。然而,左侧背外侧前额叶皮层的确切位置和连接模式因个体而异,导致治疗反应的变异性。因此,确定个性化的rTMS靶点可能在最佳治疗抑郁症患者方面发挥关键作用(详见综述[13,120])。事实上,两项脑功能磁共振成像-经颅磁刺激(fMRI-TMS)研究【121,122】报告了个体化功能连接预测的个性化靶点与抑郁症患者rTMS治疗的临床反应之间的一致关联。然而,当使用群体平均rTMS靶点时,这种关联消失,这表明个性化rTMS靶点可能比群体平均靶点更有用于预测临床结果。值得注意的是,先前的研究【123,124,125,126】报告称,可靠的个体级别功能网络连接的估计可能需要大量的数据采集(例如,5小时的静息态功能磁共振成像数据),这对临床研究是具有挑战性的。最近的一项研究【127】开发了一种新颖的个性化TMS定位方法,利用个性化的基于fMRI的功能连接和皮层折叠模式来识别最优TMS线圈放置位置。该研究通过为每个患者使用30分钟的多回波fMRI数据,展示了个性化TMS定位的临床应用的可行性【127】。
BOX 4 神经调节:经颅磁刺激(TMS)
经颅磁刺激(TMS)是一种非侵入性技术,利用快速交替的磁场来刺激大脑特定的皮层区域,从而在底层皮层组织中引发电流和动作电位【25】。TMS治疗抑郁症的生物机制被认为涉及到突触可塑性的短期和长期变化,突触可塑性是神经元根据经验对其连接进行修改的能力。在短期内,根据刺激的频率和强度,rTMS可以增加或减少刺激区域神经元的兴奋性。例如,高频重复脉冲(例如20-50 Hz)被认为会激发皮层活动,而低频刺激(例如1 Hz)则会抑制活动。长期来看,rTMS通常被认为会引起大脑中的神经可塑性变化,这可能与治疗效果有关。这些变化可能包括神经递质系统的调节(如多巴胺、5-羟色胺和谷氨酸)、突触连接的改变以及神经元生成(新神经元的形成)。然而,这些效应的确切机制仍在研究中。TMS改变了皮层刺激部位与任何远程目标或一组目标之间的通信,影响着大脑区域的分布网络【13】。在与抑郁症相关的脑区中,左侧背外侧前额叶皮层(dlPFC)和亚属前扣带皮层(sgACC)被最频繁地选择为局部脑刺激的靶点【25,117., 118., 119.】。其他靶点包括背内侧前额叶皮层(dmPFC)【128】和眶额叶皮层(OFC)【130】,可能会影响不同的神经网络。TMS通常用于治疗对药物抵抗的抑郁症,通常每周进行四到五次,治疗持续4-6周。TMS的反应率通常在29-46%之间,缓解率在18-31%之间【9】。
个性化的经颅磁刺激(rTMS)可能是治疗特定抑郁症状的一种有前景的方法,通过针对特定的脑网络进行靶向治疗【128., 129., 130.】(有关综述,请参阅【25,26】)。例如,一项研究发现,抑郁症状中的沮丧、无趣和自杀思绪对涉及与亚属前扣带皮层(sgACC)具有互相对应功能连接的背外侧前额叶皮层(dlPFC)部位的刺激反应最佳,而焦虑和躯体症状(如失眠、性欲减退和易怒)对涉及后部dlPFC区域与内侧前额叶皮层(mPFC)之间功能连接的不同回路的刺激反应最佳【129】。另一项研究开发了一种新方法来确定个性化的、症状特异性的TMS靶点。具体而言,该研究结合了每个人的全脑静息态功能连接、抑郁症状评分和电场建模,以预测焦虑痛苦患者症状变化【132】。提出了一种通用的研究方案,用于进行电场优化、基于fMRI的网络连接引导和个体特异性的TMS靶向治疗【133】。这一系列研究突出了确定症状特异性脑网络的重要性,这可能为不同症状、患者亚组或治疗个性化提供新的治疗靶点【25】。虽然基于脑网络的个性化rTMS具有前景,但其临床疗效需要通过随机临床试验进行验证。
值得注意的是,许多脑网络研究【25】表明,rTMS不仅可以刺激目标区域(例如dlPFC),还可以刺激与目标区域功能连接的网络(例如FPN)中的其他区域。此外,单脉冲TMS研究【134,135】也证明了与网络的靶向相关性。这些发现将rTMS研究的重点从单一脑区转移到了大规模脑网络,以改进对抑郁症的TMS定位。
以dlPFC为靶点,静息态功能磁共振成像(rs-fMRI)研究的发现一致指出dlPFC与亚属前扣带皮层(sgACC)的连接性(例如DMN-FPN)下降与TMS治疗的疗效相关【117,136,137】。以dmPFC为靶点,更好的治疗结果与dmPFC与丘脑/纹状体情绪相关区域(例如DMN-LIM)之间的功能连接增加相关【138,139】。在TMS之前的基线中,sgACC与FPN多个区域之间的过度连接【80,137,138,140】或欠连通【118,119,121,122】可以预测TMS后临床改善的程度。这些发现表明,TMS对dlPFC的作用可能与抑制sgACC的神经活动远程相关,而TMS对dmPFC的作用可能与对情绪功能的执行控制的改善相关。
深脑电刺激(DBS)
深脑电刺激(DBS)(参见Box 5)可能通过调节额顶网络(FPN)、背侧注意力网络(DAN)、默认模式网络(DMN)和边缘网络(LIM)内部和之间的功能连接来改善抑郁患者的临床病理【141】。支持这一观点的是,最近的一项多模态研究(结构磁共振成像和/或头部CT结合静息态功能磁共振成像)利用了14个独立数据集【142】发现,调节抑郁的DBS和TMS刺激位置与涉及FPN和DAN的脑回路连接,并且与DMN和LIM呈反相关,这可能代表了对抑郁症的精细化神经刺激靶点。
Box 5 神经调控:电抽搐疗法(ECT)、深脑电刺激(DBS)和迷走神经刺激(VNS)
电休克疗法(ECT)也是一种非侵入性的医学治疗方法,仍然是药物抵抗性抑郁症最有效的方法。ECT通过电极传递电流到大脑,有意触发短暂的癫痫发作,通常持续时间不到60秒,患者在麻醉下进行。ECT刺激通常通过电极在额叶和/或颞叶进行双侧或单侧放置。ECT通常每周进行两到三次,疗程为3-4周。ECT的治疗反应率(50-80%)比其他目前可用的治疗方法更好[10],ECT的缓解率通常在48%至65%之间[15]。
深脑电刺激(DBS)是一种侵入性的神经调控技术,通过手术植入电极到深部神经靶点,向特定的脑区输送低电压电脉冲以调节脑活动[12]。对于难治性抑郁症的治疗,已提出了多个刺激靶点,已经提出了几个刺激靶点用于治疗难治性抑郁症,例如胼胝体扣带回(SCC)、脑室边缘/脑室顶(VC/VS),以及中脑束。DBS通常需要4-6个月才能发挥作用。治疗反应率和缓解率分别为56%(范围为43%至69%)和35%(范围为27%至44%)[11]。
迷走神经刺激(VNS)[201,202]也是一种经FDA批准的神经调控治疗,用于慢性抑郁症对至少两种不同类型的抗抑郁药物无效的患者。目前,由于在VNS联合进行的基于fMRI的连接组研究有限,因此我们在此提供了VNS的生物学机制的简要概述,以使内容完整。简而言之,VNS使用一种设备以电脉冲刺激迷走神经(一条从脑干延伸通过颈部到腹部的长神经)。该设备发送电信号到迷走神经,然后迷走神经传输到大脑,在那里可以影响情绪、食欲和其他生理过程。据我们所知,只有一项fMRI研究[203]报告了经皮迷走神经刺激可以通过调节涉及DMN的功能连接改善抑郁症状。
在最近的一项静息态fMRI研究中[143],对患有抑郁症、双相障碍或厌食症的患者进行的带有SCC(胼胝体扣带回)位点的DBS抑制了皮质-边缘系统区域的活动。此外,SCC-DBS通过增强三个种子区域(如dACC、PCC和前顶叶)之间的功能连接,dACC与前扣带、mPFC和额极之间的功能连接,PCC与IFG、运动皮质区域和亚皮质结构之间的功能连接,以及前回与岛叶-运动区皮层、颞区和枕下叶之间的功能连接,来调节皮质-边缘系统的功能连接。SCC-DBS还与右侧和左侧dACC之间的功能连接和右侧dACC与运动皮质区域之间的功能连接减弱相关。同一研究团队的另一项静息态fMRI研究[144]报告了在一个亚队列患者中,SCC-DBS导致了缰核(LIM区域)与多个前额叶和皮质-边缘系统区域(如mPFC、dlPFC、ACC和PCC)之间的功能连接增强。总的来说,SCC-DBS似乎通过增加LIM与DMN/FPN/SAN之间的功能连接以及SAN与DMN之间的功能连接,同时减少SAN内部和SAN与SMN之间的功能连接,来调节抑郁情绪。
除了fMRI外,构建自电生理学数据(特别是颅内脑电图,iEEG)的功能连接组学已被用于确定DBS的靶点。一项最近的研究[145]在一名女性患者身上实施了一种新颖的生物标记驱动闭环DBS治疗,该患者对抗抑郁药物、ECT和TMS等不同类型的治疗都没有反应。具体来说,研究者刺激并测量了植入在OFC、杏仁核、海马体、腹侧囊(VC/VS)和sgACC的十个iEEG电极的神经活动[12]。他们确定了几个状态依赖的症状特异性DBS靶点,并通过估计从先前提到的脑区记录的神经信号的有效连接性构建了一个有向连接组。在该有向连接组中,右侧VC/VS具有最高的带权出度,因此被确定为DBS的靶点。结果显示,在刺激VC/VS位点时,杏仁核产生了强烈的诱发响应(例如,增加了VC/VS-杏仁核的连接)。作者使用扩散张量成像(DTI)数据来确定杏仁核与VC/VS之间的结构连接,从而提供了两个脑区之间有效连接性的支持证据(即轴突纤维束;请参阅另一项研究[146])。此外,降低的杏仁核γ波功率与抑郁症状改善有关,并且可以通过VC/VS刺激进行调节。因此,确定的VC/VS-杏仁核回路可能作为一个有前途的个性化症状特异性生物标志物,并在该研究中转化为闭环治疗。这项研究的发现强调了在准确开发以网络为导向、症状特异性的个性化DBS靶向时整合多模式神经影像技术(即dMRI和iEEG)的重要性。
基于Menon的三重网络模型[20]的启发,我们提出了一个三维网络模型,为理解特定抑郁症状与功能子网络(或RSN)之间的连接变化以及不同疗法的效果提供了一个概念框架(图2)。简而言之,Menon的三重网络模型认为,SAN、FPN和DMN的异常功能组织及其动态跨网络相互作用是多种心理病理学(包括重度抑郁症)的基础。因此,三重网络模型本质上是一个二维模型,将三个RSN(网络维度)中的脑网络变化与多种心理病理学(认知功能异常维度)相关联。在本文中,我们重点关注MDD,并通过添加疗法维度来扩展三重网络模型,突出不同疗法对特定症状的脑网络变化的共同或独特效应。此外,随着该领域的发展,除了三重网络模型中包含的三个脑子网络(SAN、FPN和DMN),最近的研究还发现了其他脑子网络,如前面所述的DAN、LIM和感觉网络(SMN和VIS),这些网络在患有MDD的患者中显示出异常的网络连接与对照组相比。因此,我们将网络维度从三个网络扩展到七个网络。
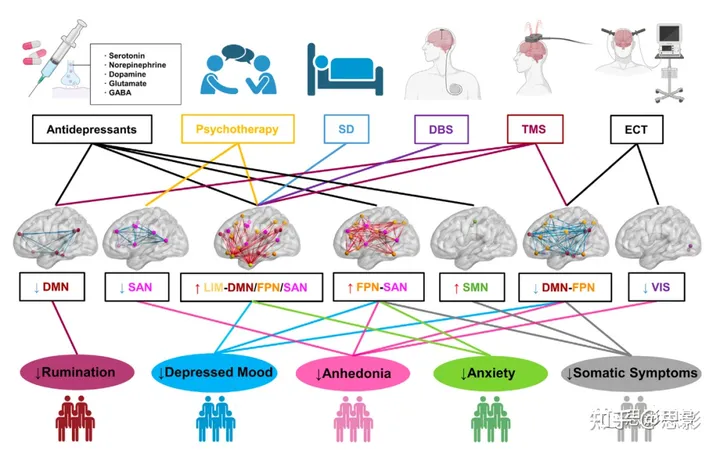
图2. 症状特异性、网络引导的治疗的假设模型。
该模型是通过对新兴文献中描述的六种治疗、涉及七个RSN的脑网络异常以及五种抑郁症状之间的关联的关键研究进行总结创建的(详见主文中的表1)。在症状多样的抑郁患者中发现了多个RSN的异常功能连接。每个RSN中显示的异常连接往往与其相关的认知领域的抑郁症状相关。值得注意的是,不同类型的治疗可能会调节常见或独特的认知相关RSN内部和/或之间的异常连接,从而改善特定亚型的抑郁症状,例如沉思、情绪低落、无欲、焦虑、躯体症状等。具体而言,通过使用抗抑郁药物和TMS来调节DMN连接,可以减少抑郁患者中的沉思水平。抗抑郁药物、TMS和ECT可以调节FPN和SMN相关的连接,并降低躯体症状的水平。除了两个感觉网络SMN和VIS外,所有六种治疗都可以通过调节FPN与其他RSN之间的连接来减少情绪低落的水平。不同类型的治疗(除了SD和DBS)引起的SAN、FPN和VIS相关连接的变化与无欲水平的降低相关。多种治疗方法(除了ECT)被用于调节FPN和SAN之间的网络连接,可以降低焦虑水平。
缩写:DBS,深部脑电刺激;DMN,默认模式网络;ECT,电休克疗法;FPN,额顶网络;LIM,边缘网络;RSN,静息态网络;SAN,突显网络;SD,睡眠剥夺;SMN,体感运动网络;TMS,经颅磁刺激;VIS,视觉网络。
我们假设的网络模型的主要目标是提供一个理论框架,用于检验在重度抑郁症中功能连接改变与特定症状和治疗方法之间的关系,从而最终促进发展症状特异性、网络引导的治疗靶点。例如,研究发现,与沉思有关的DMN过度连接可以通过抗抑郁药物【68,72,93,94】和TMS【137】来减少(见图2)。然而,反复发作抑郁的患者在使用抗抑郁药物后显示了异常的DMN低连通性【49】,这表明进一步降低DMN连接到异常水平可能会重新诱发抑郁症状。未来的研究可以使用网络控制工具结合抗抑郁药物或TMS,以最佳方式控制DMN连接,从而保持治疗的效益【147,148】。在相同的思路下,其他治疗方法,如心理疗法、SD、电休克疗法和DBS,可以用于调节特定认知相关RSN【表1】,改善相应的抑郁症状亚型,如情绪低落、无欲、焦虑和躯体症状(见图2)。需要注意的是,尽管我们利用现有数据来加强我们的模型,但我们承认某些提出的关联是假设,而不是已确立的事实。当然,这个框架需要通过实证研究来验证,不仅在人类研究中,还需要在动物模型中进行验证,以确保其准确解释抑郁症的病理生理学,并为开发有效的治疗方法提供基础。
结语和未来展望
本文从网络的角度探讨了抑郁症的机制和抗抑郁效应,以促进网络引导的个体化治疗靶点的发展。通过使用现代神经影像工具和连接组模型,我们将抑郁症概念化为一种网络失调,其在多个静息状态网络内部和网络之间表现为异常的低连接性和高连接性。抗抑郁治疗通过调节这些静息状态网络之间的特定连接性来改善特定维度的抑郁症状。令人鼓舞的是,治疗后调节的网络连接性似乎与临床改善相一致。因此,这些静息状态网络可能是抑郁症和抗抑郁效应的共同基础,支持着越来越多的观点,即网络水平的效应在理解抑郁症的病理生理学和治疗机制方面可能很重要,并强调了靶向脑网络调节的治疗潜力【142,149,150】。
重要的是,不同的治疗方法倾向于调节不同静息状态网络(RSN)的与症状相关的连接性变化(见图1),表明这些治疗方法具有不同的从脑到行为的效应。例如,药物治疗通常会调节分布在不同脑网络中的神经递质受体。相比之下,TMS和DBS倾向于调节更具体的静息状态网络中的连接性。这可能是由于不同治疗方法的不同神经生物学机制(Box 2,Box 3,Box 4,Box 5)所致。例如,神经递质受体分布在不同的脑网络中,并被认为对药物治疗等产生反应,而像重复经颅磁刺激(rTMS)和深部脑电刺激(DBS)这样的局部脑刺激治疗则必然会针对特定脑网络的特定区域。值得注意的是,rTMS和DBS的效应不仅限于刺激区域,而会传播到网络的特定下游部分。然而,由于缺乏直接比较不同治疗方法(例如药物治疗与rTMS)对功能脑网络变化的影响的研究,我们无法排除不同治疗方法对网络变化的不同效应可能是由于研究的异质性,如个体的遗传、环境和临床异质性。尽管如此,我们认为可靠的症状特异性、网络引导的治疗靶点可能在具有更均质的基因型和表型的个体中得到确认(见待解决问题)。因此,为了控制异质性问题,在未来的可比较研究中可以考虑采用均质抽样方法【151】。
关于特定治疗对脑亚网络和相关症状的变化的发现支持了这样的猜测:患有多种抑郁症状的患者可能通过同时调节多个静息状态网络(RSN)的连接性来获益于多种症状特异性治疗的组合(见待解决问题)。越来越多的文献表明,结合多种治疗方法可以维持临床效果。例如,西酞普兰与哌酯胺的联合应用相较于任何一种药物单独应用,可以获得更高的缓解率【152,153】。不同类型的治疗方法的联合(例如抗抑郁药和心理疗法)提高了抑郁症的缓解率,并降低了复发率和再发率【154,155】。在服用抗抑郁药的患者中,睡眠剥夺与较低的复发率相关【106】。神经影像学和连接组学技术可以帮助确定针对抑郁症的症状特异性和网络引导的联合治疗计划,最终促进为每个患者实现个体化的治疗。
大多数脑-表型建模研究假设单一的脑-表型关系能够适用于所有个体,但模型在所有参与者中的表现并不相同,特别是在那些不符合样本典型特征的参与者中【156】。最近的研究【157,158】发现了将群体特定模型推广到其他社会人口群体的局限性。此外,个体之间的功能网络拓扑差异【123,126,159,160】经常被报道,这也可能导致难以在研究之间匹配网络【161】。此外,不同研究中由“抑郁”量表所测量的内容重叠不一致,这可能会增加额外的噪音【162】。此外,研究结果在不同研究中的不一致性可能可以通过个体水平和群体水平分析所捕获的不同变异源来解释。特别是,个体的病理情况可能在群体水平的聚合统计估计中丢失。例如,一项研究【163】发现,从聚合数据中得出的结论可能是不准确的,因为个体之间的方差是群体的四倍。因此,在所讨论的研究中,群体间的样本差异可能是真实存在的,但其权重取决于该时间点群体中最异常患者的大脑/症状状态。这种群体到个体推广的失败已被认为是人类研究中的一个特殊挑战【164】。未来的研究将专注于开发个体化的目标,有望克服群体水平分析的局限性。
在神经影像学文献中可能存在真实效应,但肯定也有无法证伪的假阳性,直到使用更好描述的样本(例如,深度表型[165])与更广泛的统计方法相结合,这些方法不那么专注于定位单一的脑区域【166】(参见未解决的问题)。此外,利用多回波fMRI【167】可以提高静息态连接测量的测试-重测可靠性,这将促进对临床人群中功能性脑网络的纵向精确映射。此外,最近的研究发展了几种计算模型,如规范建模[168]和功能随机森林[169],用于克服共病和异质性问题[170]。最后,正如前面提到的,MDD的病理过程是一个多因素的过程,取决于临床和认知功能障碍、连接组学变化和遗传学之间的相互作用。多元分析方法【171】,如典型相关分析、偏最小二乘法和结构方程模型,可能是整合多维数据并研究它们之间关系的有希望的工具,尽管它们可能需要大样本量来确保足够的统计功效和可靠性【172,173】。
为了增加统计功效和结果的推广性,未来的研究应利用大规模多中心的数据集,例如英国生物银行【174】、增强神经影像遗传学的元分析(ENIGMA)联盟【175】和青少年大脑认知发展(ABCD)研究【176】。与此同时,应使用统计协调方法来减少由于不同扫描仪制造商、成像采集协议和被试招募标准导致的研究中心相关差异的混淆效应。例如,可以使用广泛使用的ComBat协调方法【51,52】和其他方法【177,178】成功消除功能连接测量中的研究中心效应。
展望未来,考虑到抑郁症的异质性,单一的神经影像标记很难捕捉到所有重要的抑郁症特征(见未解决的问题)。多模态神经影像技术,如结构、功能和扩散张量成像,提供了互补但也冗余的信息来估计个体化的连接图。最近开发的多层生物物理网络模型【179,180】可以用于整合功能和结构网络连接模式,研究不同网络配置之间的相互作用,这可能提供更可靠的标记以辅助诊断和确定个体化的治疗目标。此外,为了解决抑郁症的临床异质性,可以使用症状和治疗特异性的大规模脑网络连接模式【27,80,181】来识别生物学上的抑郁症亚型。然而,当前的抑郁症生物分型尚未得到最佳的再现性。MDD已根据特定症状的存在与否、发病年龄、严重程度和其他临床特征进行了分类。需要注意的是,只有在我们能够在重性抑郁症中找到明显的生物学(例如脑网络特征)和临床特征时,才能识别出可靠的抑郁症生物分型。然而,由于该疾病的生物学和临床异质性【169,182】,识别可靠的抑郁症生物分型仍然是一个挑战(见未解决的问题)。此外,基因型和环境因素在鉴定重性抑郁症生物分型中也可能起到重要作用【183】。因此,我们认为,可靠的重性抑郁症生物分型可能会在具有更加同质的基因型和表型的个体中被鉴定出来。未来的神经影像研究应该利用连接组学【16,184】、高质量【185】和大样本神经影像数据【172,186】以及数据降维方法【187】和适当的统计或机器学习技术【188,189】来识别可复制和可解释的基于连接组的抑郁症生物分型,最终应用于临床实践【190】。
总之,新出现的证据表明,抑郁症症状很可能与多个脑亚网络的异常功能网络失调有关,而不同的治疗可能通过调节特定脑亚网络的功能连接来改善特定的症状。所提出的假设性三维网络模型提供了一个概念框架,用于综合广泛的研究,以研究不同治疗的效果与多个功能亚网络之间的脑连接变化以及抑郁症的具体症状之间的关系。我们希望这篇文章和假设性网络模型能够促进个性化的症状特异性和连接组导向的治疗目标的发展。
未解决的问题
我们如何开发新的脑刺激技术和机器学习工具,以准确地将症状映射到脑网络上?目前尚不清楚不同的抑郁症状是否与不同脑网络的特定连接变化相关。
不同的治疗方法(例如,TMS与药物)如何相互作用,并以何种方式共同治疗患有多种症状的患者?对于症状异质的患者,应该以何种可行的时间顺序应用不同的治疗方法?
我们如何准确提取和整合每种神经影像模态的独特神经信息?不同的神经影像方法可以提供互补但也有重复的神经信息。
我们如何确定可重复和可解释的基于连接组的、症状和治疗特异性的抑郁症生物类型?目前,基于神经影像的机器学习模型所确定的抑郁症生物亚型通常难以推广。
在识别基于连接组的、症状特异性定位时,哪些空间和时间尺度最有价值?目前,人类连接组分析在结构和功能上进行了不同的空间和时间尺度,导致结果的可变性高,重复性低。
原文:Functional connectomics in depression: insights into therapies
本文链接:https://my.lmcjl.com/post/12684.html

4 评论